Lectura 2:00 min
Pfizer solicita a EU que autorice uso de emergencia de la tercera dosis de su vacuna contra Covid-19
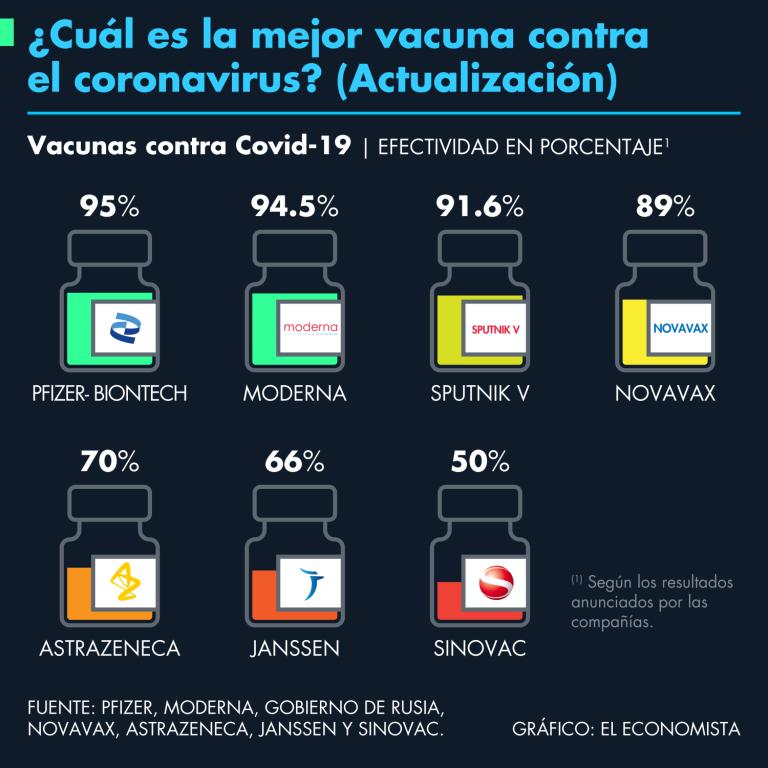
Pfizer y BioNTech informaron a finales de octubre que los ensayos clínicos realizados en 100,000 personas arrojaron que la tercera dosis de su vacuna tiene un 95.6% eficacia contra la infección sintomática.

Foto: Reuters
Pfizer y BioNTech anunciaron el martes que han presentado formalmente una solicitud ante la Agencia de Alimentos y Medicamentos (FDA) para que autorice el uso de emergencia de una tercera dosis de su vacuna contra Covid-19 para personas mayores de 18 años.
Las empresas informaron a finales de octubre que los ensayos clínicos realizados en 100,000 personas arrojaron que la tercera dosis de su vacuna tiene un 95.6% eficacia contra la infección sintomática.
La FDA ya había concedido en septiembre la autorización de uso de emergencia para una tercera dosis de la vacuna de las dos compañías para las personas mayores de 65 años, así como para las personas con alto riesgo de desarrollar una forma grave de Covid-19.
La propuesta inicial de Pfizer para la aprobación de la tercera dosis a todas las personas de 16 años o más, apoyada por la administración del presidente Joe Biden, fue rechazada por la FDA en aquel momento.
Varios países han aprobado las vacunas de refuerzo contra el Covid-19 para aumentar la inmunidad, ya que algunos estudios revelaron que la protección de los inoculados disminuye después de varios meses.
La Agencia Europea del Medicamento (EMA) aprobó la dosis de refuerzo para mayores de 18 años a principios de octubre, permitiendo a los reguladores nacionales decidir qué grupos deben ser elegidos primero.
kg















